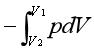阿伏加德罗常数是什么?
在物理学和化学中,阿伏伽德罗常数(符号:NA或L)的定义是一摩尔物质中所含的组成粒子数(一般为原子或分子),记做NA。因此,它是联系粒子摩尔质量(即一摩尔时的质量),及其质量间的比例系数。其数值为:
国际单位制数值(2019年,人为定义):6.02214076×1023mol?1
CODATA建议数值(2006年,基于实际测量所得):6.02214857(74)×1023mol?1
扩展资料
历史
较早的针对化学数量的定义中牵涉到另一个数,阿伏伽德罗数,历史上这个词与阿伏伽德罗常量有着密切的关系。一开始阿伏伽德罗数由让·佩兰定义为一克原子氢所含的分子数;后来则重新定义为12克碳-12所含的原子数量。
因此,阿伏伽德罗数是一个无量纲的数量,与用基本单位表示的阿伏伽德罗常量数值一致。在国际单位制(SI)将摩尔加入基本单位后,所有化学数量的概念都必需被重定义。阿伏伽德罗数及其定义已被阿伏伽德罗常量取代。
阿伏伽德罗常数
阿伏伽德罗常量(Avogadro constant),旧称阿伏伽德罗常数,为热学常量,符号NA。它的精确数值为:6.02214076×1023,一般计算时取6.02×1023或6.022×1023。气体表达公式为:n=N/v,液体表达公式为:n=c*v。
在物理学和化学中,阿伏伽德罗常数的定义是一摩尔物质中所含的组成粒子数(一般为原子或分子),记作NA。因此,它是联系粒子摩尔质量(即一摩尔时的质量),及其质量间的比例系数。
阿伏伽德罗常量因阿莫迪欧·阿伏伽德罗而得名,他是一名19世纪早期的意大利化学家,在1811年他率先提出,气体的体积(在某温度与压力下)与所含的分子或原子数量成正比,与该气体的性质无关。法国物理学家让·佩兰于1909年提出,把常数命名为阿伏伽德罗常量来纪念他。佩兰于1926年获颁诺贝尔物理学奖,他研究一大课题就是各种量度阿伏伽德罗常量的 *** 。
阿伏伽德罗毕生致力于化学和物理学中关于原子论的研究。当时由于道耳和盖-吕萨克的工作,近代原子论处于开创时期,阿伏伽德罗从盖-吕萨克定律得到启发,于1811年提出了一个对近代科学有深远影响的假说:在相同的温度和相同压强条件下,相同体积中的任何气体总具有相同的分子个数。
但他这个假说却长期不为科学界所接受,主要原因是当时科学界还不能区分分子和原子,同时由于有些分子发生了离解,出现了一些阿伏伽德罗假说难以解释的情况。直到1860年,阿伏伽德罗假说才被普遍接受,后称为阿伏伽德罗定律。它对科学的发展,特别是原子量的测定工作,起了重大的推动作用。
阿伏伽德罗常数单位是什么?
单位是 /mol(读作每摩尔)。
阿伏伽德罗常量(Avogadro constant),又名阿伏伽德罗常数,为热学常量,符号为NA。它的精确数值为:6.02214076×1023,一般计算时取6.02×1023或6.022×1023。阿伏伽德罗常量是12克12C所含的原子数量。将12C选为参考物质是因为它的原子量可以测量得相当精确。
阿伏伽德罗常数
在物理学和化学中,阿伏伽德罗常量(符号:NA或L)的定义是一个比值,是一个样本中所含的基本单元数(一般为原子或分子)N,与它所含的物质的量n(单位为摩尔)间的比值,公式为NA=N/n。因此,它是联系一种粒子的摩尔质量(即1摩尔时的质量),及其质量间的比例常数。
阿伏伽德罗常量用于代表1摩尔物质所含的基本单元(如分子或原子)之数量,阿伏伽德罗常量的定义值是指0.012千克12C所含的原子数,6.02×1023。这个数值是阿伏加德罗常数的近似值,两者是有区别的。阿伏加德罗常数的符号为NA,不是纯数。其单位为/mol。
以上内容参考:百度百科——阿伏伽德罗常数
什么是阿伏伽德罗常数
其实就是一个单位量,就像买菜用斤,花钱用元,具体一斤等于500克,这个是规定,便于理解的。
比如我们有夏天,收了很多麦粒,但是我们直接说几万,几十万粒实在太多了,那我们就分堆,一堆就是阿伏伽德罗常数粒,然后看我们数了几堆,例如5堆,物质的量就是5mol,而微粒数就是总共多少粒,很明显,总的微粒数=堆数×每堆的个数
质子和中子质量一样,把他们统一一个称呼:核子。
核子质量多少呢,太小没法称,想了个办法,我称出来一克核子,然后数了一下一克的核子有多少个,因为核子质量一定,所以这个数是一个固定值,把这个数称为阿伏伽德罗常数。
把这个数包装为一个基本单位,称为1摩尔。就好像一筐鸡蛋的一筐(楼上某层),或者一打(12个)包子的一打。就是一个数字的量的单位。
现在去理解书上的定义,碳12有12个核子(6质子+6中子),1摩尔核子1克,1摩尔碳12应该12摩尔核子,等于12克。所以,书上说12克的碳12的数量是1摩尔。
就这么简单,书上是把简单问题复杂化了。物理数学善于干这个,为了严密而把简单定理复杂化。化学平时不这么玩,偶尔一个定理复杂点就成了难点。